Anbieter zum Thema
Im Folgenden werden SEC-Chromatogramme während des Downstream-Prozesses gezeigt. In einer Reihe aufeinander folgender Schritte wird der monoklonale Antikörper gereinigt. Zunächst erfolgt eine Zellernte mit Klärung und Konzentrierung. Im Anschluss daran wird ein Capture-Schritt (Protein A-Affiniftätschromatographie), gefolgt von einem Zwischenschritt zur Entfernung von Kontaminanten (z.B. Kationenaustauscher) sowie ein Aufreinigungsschritt zum Polishing (Anionenaustauscher) durchgeführt. Anschließend folgt eine Virusfiltration und eine finale Ultrafiltration [vergleiche auch 7].
Um die Reinheit des Antikörpers zu bestimmen, wird eine SEC-Analytik von Proben während des Prozesses durchgeführt. Gezeigt werden Chromatogramme nach der ersten Klärung der Zellernte (s. Abb. 3) und nach der Protein A-Affinitätschromatographie (s. Abb. 4).
Die HPLC-Analyse nach der ersten Klärung der Ernte (s. Abb. 3) zeigt eine Vielzahl an Kontaminationen, z.B. Host-Cell-DNA, Host-Cell-Proteine, Endotoxine, Komponenten des Mediums, produktbedingte Verunreinigungen, sowie Aggregate. Diese gilt es in den nachfolgenden Schritten zu entfernen. Im folgenden Schritt, der Protein A-Chromatographie wird die gezielte Affinität von Protein A zu Immunglobulin G (IgG) genutzt. Eingesetzt wird ein Sartorius Sartobind Protein A-Adsorber (93PRAP06HB-12-A). Die Probe nach der ersten Klärung (s. Abb. 3) wird über die Protein A-Einheit filtriert. Das IgG bindet an den Protein A-Adsorber, während die Kontaminanten den Adsorber durchlaufen. Die Elution von Protein A wird per HPLC-SEC-Analyse untersucht (s. Abb. 4). Die analysierte Elutions-Probe der Protein A-Affinitätschromatographie zeigt eine deutliche Aufreinigung des monoklonalen Antikörpers. Der Anteil der Aggregate und der Kontaminanten wird stark vermindert. Die Auftrennung mittels HPLC-SEC-Analyse zeigt zwei Peaks (s. Abb. 4). Diese lassen sich anhand ihrer Retentionszeiten mittels des Standards in molekulare Größen berechnen. Die Peakflächen der erhaltenen Peaks geben Aufschluss über den Anteil von Aggregaten und Monomer in den mAB-Lösungen (s. Tab. 4).
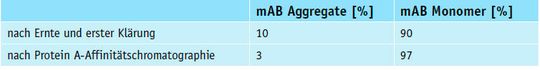
Die SEC-Analyse der Anteile von Aggregaten und Monomer des mAb nach Ernte und erster Klärung (s. Abb. 3) zeigt noch 10 % an verunreinigenden mAb-Aggregaten (s. Tab. 4). Der weitere Aufreinigungsschritt mittels Protein A-Affinitätschromatographie zeigt in der SEC-Analyse (s. Abb. 4) eine Verringerung des Aggregatanteils auf 3 % (s. Tab. 4). Weitere Kontaminanten sind in der SEC-Analyse nicht mehr nachweisbar. Die erzielten Ergebnisse belegen eindeutig die Brauchbarkeit der eingesetzten Methode.
Fazit: Reinstwasser für HPLC-SEC geeignet
Die HPLC-SEC-Analytik ist ein wichtiges Werkzeug zum Nachweis der Reinheit therapeutischer Proteine, und wird im Herstellprozess von monoklonalen Antikörpern als Standardmethode zur Bestimmung des Aggregatgehaltes und dem Anteil an Verunreinigungen weltweit eingesetzt. Da die Integrität der Proteine (hier des monoklonalen Antikörpers) durch Temperaturänderungen, mechanische Effekte sowie durch pH-Wert-Änderungen und UV-Licht während seiner Produktion und des gesamten Lebenszyklus gefährdet ist (siehe auch [3]), ist es von hoher Wichtigkeit, eine verlässliche Methode zur Bestimmung der Reinheit eines mAB zu etablieren. Im Rahmen der hier gezeigten Methodik ließen sich die Aggregatzustände der monoklonalen Antikörper sehr gut bestimmen, zudem konnte eine sehr gute Aufreinigung nachgewiesen werden. Grundvoraussetzung für eine erfolgreiche Durchführung der Methodik ist die Sauberkeit der eingesetzten Substanzen/Lösungen und vor allem der des eingesetzten Wassers als Basis der Lösungen.
Wie in den Vorversuchen gezeigt (s. Abb. 1) eignet sich das von Arium Pro VF-produzierte Reinstwasser als Ansatzmittel für die Puffersubstanzen und Salze der mobilen Phase während der SEC. Bei Verwendung dieses Reinstwassers sind keine Geisterpeaks [8] durch Wechselwirkung zwischen mobiler und stationärer Phase und keine UV-aktiven Verunreinigungen oder Peakverschiebungen nachzuweisen. Starke organische Verunreinigungen (ausgedrückt in Form von hohen TOC-Werten) könnten sich in Peakverschiebungen äußern, da die Säule unpolarer wird. Schwermetallsalze (Komplexbildner) könnten Ladungen in der Säule abschirmen, was zu Faltungen der Proteine führen könnte (vermehrte Aggregatbildung der Antikörper). Diese Annahmen müssen in weiteren Versuchen abgeklärt werden.
Über den erfolgreichen Einsatz von Arium Pro-Reinstwasser bei der HPLC zur Zuckeranalytik wurde bereits berichtet [9]. Die dabei und bei der hier gezeigten Analytik gemachten guten Erfahrungen hinsichtlich der Nutzbarkeit als mobile Phase sollen in Zukunft auf andere Trenntechniken z.B. der UHPLC ausgedehnt werden.
(ID:43907826)





:quality(80)/p7i.vogel.de/wcms/34/d3/34d3b6a2d5be70f0fad748b252b889ff/0128811585v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/d0/4f/d04f35fcc7a66f397a16f2b4d3e08c0e/0127939638v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/f6/14/f6145e3aca7cf4090aa15cac8c9d93b1/0127362535v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/0b/ec/0bec42bcb4a30fb626f2ec3ec2b0ec9a/0128354824v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/10/53/10531cb8757c536d4d3ea325e082f5f4/0128840645v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/2d/e2/2de2e1f1d54d02e99089eed7e4e55f7d/0128718917v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/6f/f9/6ff9ba4c960423942756399773826498/0128649503v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/b3/45/b3459157e0abe1cc8bf10a38683e996a/0128604111v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/f2/dc/f2dc3b2073e3c653f3b338e7d5a995b4/0128876197v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/d6/f2/d6f23aba544296ca2f0e0a267a9ba0fa/0128786844v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/cb/78/cb78cddefcdd5a2b0fa530ef674ec1e7/0128701847v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/bd/89/bd8966c06728c0a6e0df4b57058a766e/0128694775v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/e5/45/e5450d20f721c7ff252e9f9079be85b1/0128920134v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/cf/b0/cfb0e7efb9b6e5672ff50b43a07d179e/0128888473v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/1e/c9/1ec97c08b702c84d788eccbde8ea9e5e/0128825295v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/b3/08/b308b0f70d40fa013434c0a6e6d02f4c/0128771418v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/2e/17/2e1795b6750cc3eaad6ba81c0bc79d16/0100811496v7.jpeg)
:fill(fff,0)/p7i.vogel.de/companies/67/af/67af6642d645f/download-logo-png-data--4-.png)
:fill(fff,0)/images.vogel.de/vogelonline/companyimg/117300/117337/65.jpg)
:fill(fff,0)/images.vogel.de/vogelonline/companyimg/27600/27667/65.jpg)
:fill(fff,0)/images.vogel.de/vogelonline/companyimg/6400/6447/65.jpg)
:quality(80)/images.vogel.de/vogelonline/bdb/1009100/1009189/original.jpg)
:quality(80)/images.vogel.de/vogelonline/bdb/1009100/1009186/original.jpg)
:quality(80)/images.vogel.de/vogelonline/bdb/1009100/1009187/original.jpg)
:quality(80)/images.vogel.de/vogelonline/bdb/1009100/1009188/original.jpg)
:quality(80)/p7i.vogel.de/wcms/b3/09/b309be4e6872c44b652f29f3c2783dd0/0124701160v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/fa/8b/fa8b683ffd9f6fa6041e1ceb6fef7691/0124277831v2.jpeg)